Mehrere Beobachtungen stützen die Annahme, dass beschleunigte Alterungsprozesse in Herz und Gefäßen ursächlich für die Entstehung von Herz-Kreislauf Komplikationen sein könnten. Allerdings konnte bisher kein direkter Zusammenhang zwischen dem Vorhandensein von beschleunigt gealterten Zellen und dem Auftreten von Herz-Kreislauf Erkrankungen nachgewiesen werden. In unseren Forschungsarbeiten wollen wir diesen Zusammenhang nachweisen und durch eine gezielte Blockade von Alterungsprozessen die Regenerationsfähigkeit von Zellen im Gefäß verbessern.
Wissenschaftlicher Hintergrund
Zelluläre Seneszenz spielt nicht nur eine wichtige Rolle bei der Alterung, sondern auch bei Krankheitsprozessen und der Antwort auf bestimmte Stressreize in vivo. Dabei geht man davon aus, dass zelluläre Seneszenz den Zellpool an somatischen Zellen erschöpft, der in der Lage ist, sich zu teilen und sich dabei zu erneuern. Diese Eigenschaften sind aber unverzichtbar für Organreparatur und -integrität.
Somatische Zellen, die aufgrund eines irreparablen Stresses ein Seneszenzprogramm durchlaufen, behalten eine relativ intakte Struktur, dennoch ist ihre Funktionalität eingeschränkt. Seneszente Endothelzellen zeichnen sich durch eine verminderte Produktion von Nitritoxid (NO), Veränderungen in der Expression und Phosphorylierung der endothelialen NO Synthase (eNOS), eine verminderte Prostacyclin-Synthese, eine erhöhte Expression von Plasminogen Aktivator Inhibitor-1 und eine erhöhte Bindungsfähigkeit für Monozyten aus.
Wir konnten zeigen, dass unkontrollierte Hypertonie zelluläre Seneszenz induzieren kann. In atherosklerotischen Läsionen finden sich seneszente Endothel- und glatte Muskelzellen. Seneszente Myozyten mit signifikant kürzeren Telomeren akkumulieren in alten Herzen mit dilatativer Kardiomyopathie.
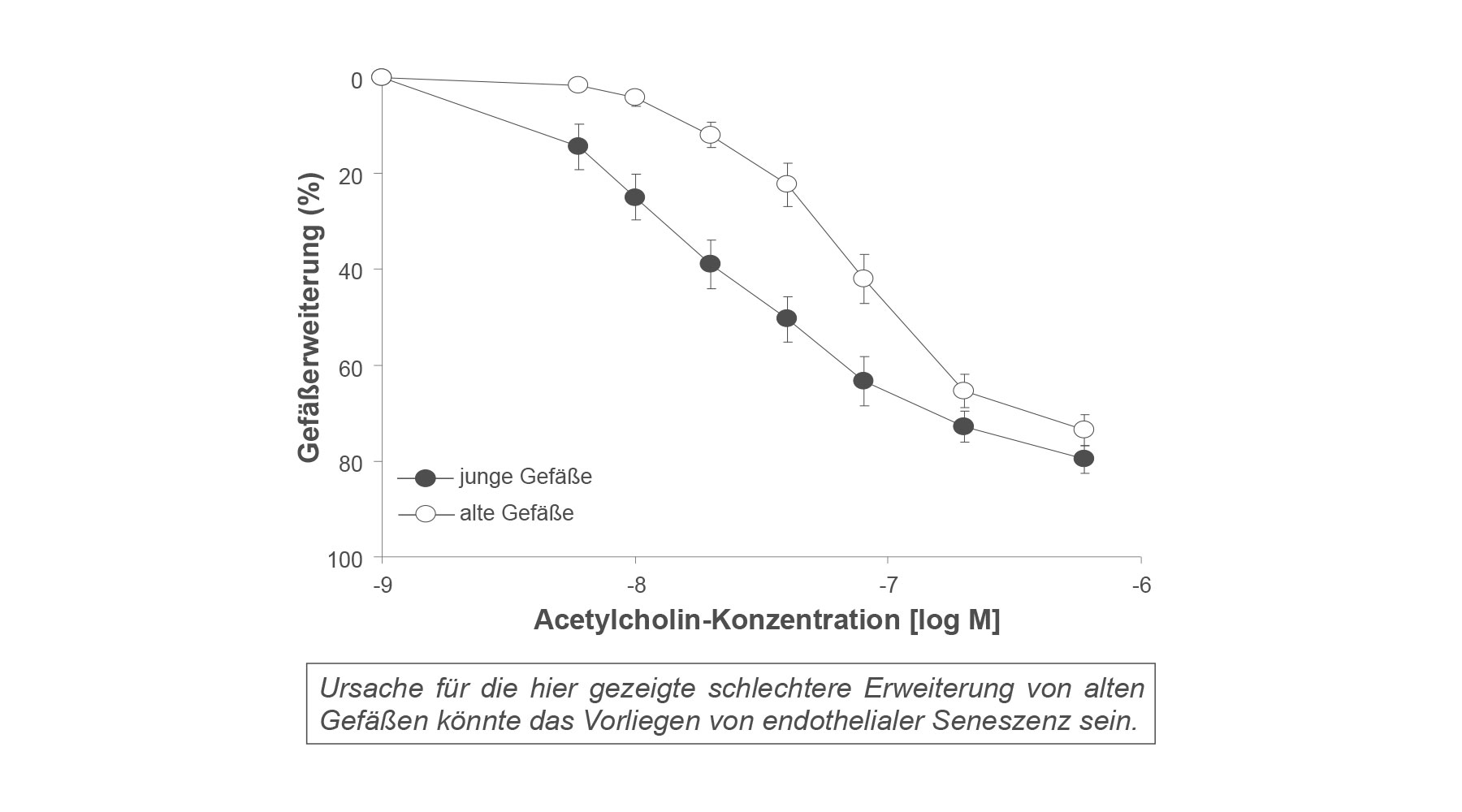
Die funktionellen Veränderungen, die seneszente Endothelzellen aufweisen, sind auch bei endothelialer Dysfunktion nachweisbar. Endotheliale Dysfunktion ist die Grundlage für atherosklerotische Veränderungen und mit Hypertonie assoziiert. Dies legt die Vermutung nahe, dass ein Zusammenhang zwischen endothelialer Seneszenz und Dysfunktion besteht.
Ziele des Projektes
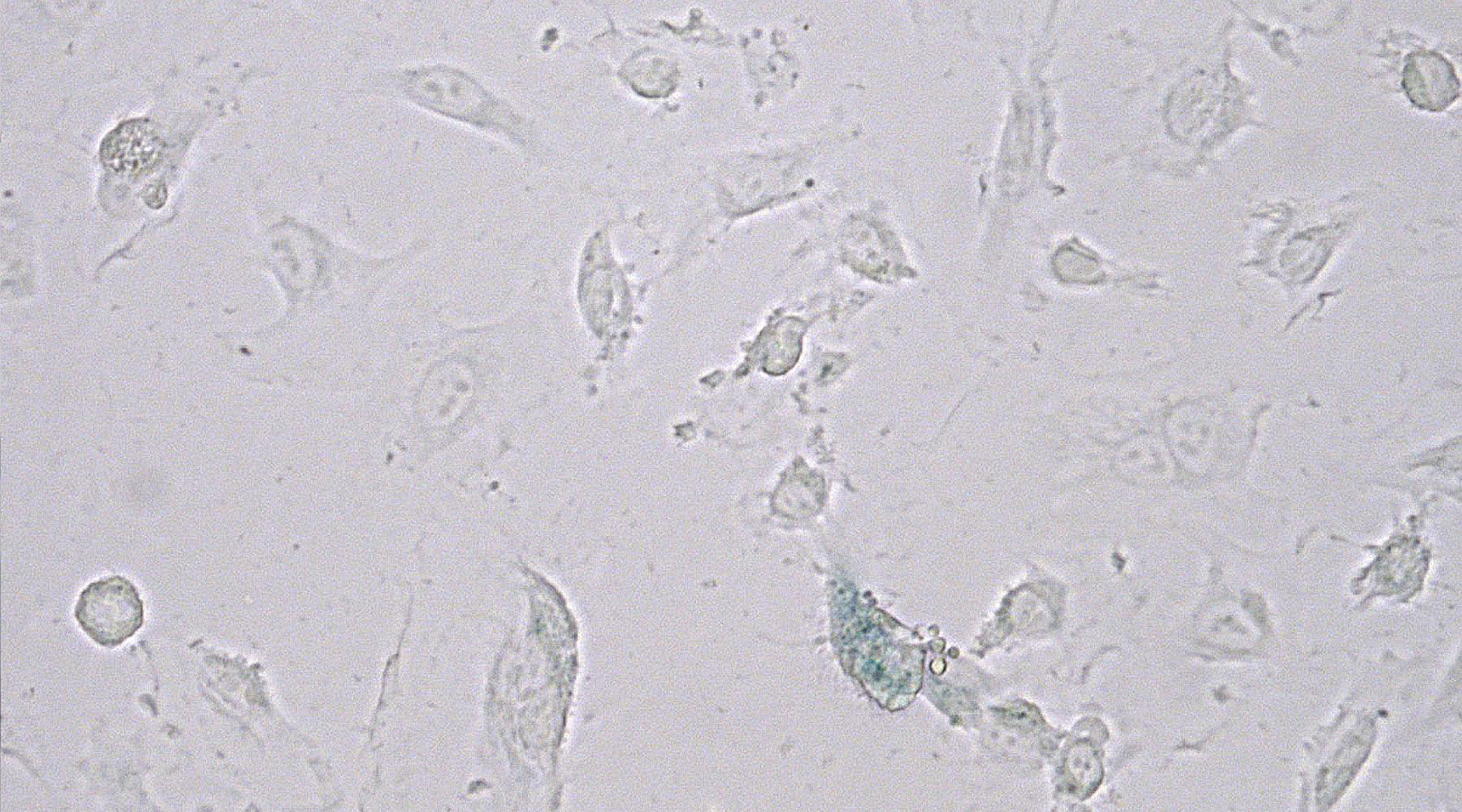
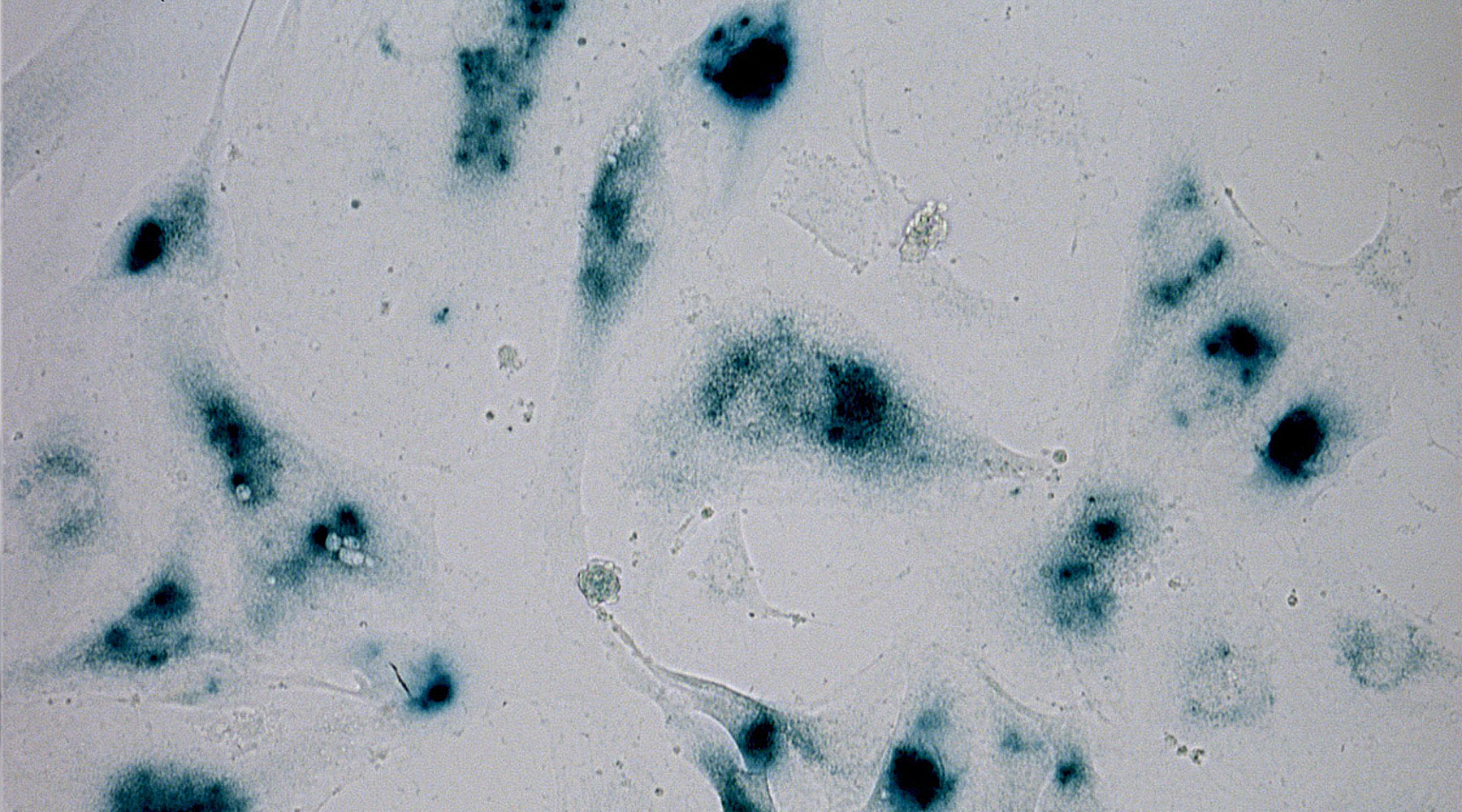
In bisher durchgeführten Experimenten wurde lediglich das Vorliegen eines Seneszenz-Phänotyps in Endothelzellen beschrieben. Unsere Hypothese ist, dass endotheliale Seneszenz ursächlich für die endotheliale Dysfunktion ist. Wir beabsichtigen, diesen kausalen Zusammenhang zwischen Seneszenz und der Degeneration endothelialer und vaskulärer Funktion in vitro and in vivo nachzuweisen. Dabei sollten Interventionsstrategien, die Seneszenz unterbinden, mit endothelialer und vaskulärer Regeneration einhergehen.
Dieses Projekt ist eng mit einer klinischen Studie verknüpft, in der wir die Auswirkungen von regelmäßiger sportlicher Aktivität auf die endogene Regeneration untersuchen (REBIRTH aktiv). In einem weiteren Projekt bearbeiten wir außerdem die Bedeutung von chronisch inflammatorischen Prozessen am Beispiel der Parodontitis für Seneszenz-Induktion und Entstehung kardiovakulärer Erkrankungen.
Forschungsmethoden

Forschungsmethoden
Neben verschiedenen molekularbiologischen, proteinchemischen und immunhistochemischen Methoden sowie Zellkulturtechniken, werden in diesem Projekt ex vivo Messungen von Endothel-abhängiger und Endothel-unabhängiger Vasodilatation durchgeführt. Diese Methode stellen wir gerne anderen Arbeitsgruppen im Rahmen einer Kooperation zur Verfügung.

Projektteam
Pädiatrische Forschung ist immer Teamarbeit. Diese Menschen arbeiten gemeinsam an unserem Projekt „Seneszenz und vaskuläre Regeneration“.

Projektpartner

Projektförderung
Dieses Projekt wird von der Deutschen Forschungsgemeinschaft gefördert. Die für das Projekt notwendigen Vorarbeiten wurden durch die European Section of the Aldosterone Council und durch das HiLF-Programm der MHH unterstützt.